:quality(75)/small/cong_thuc_Lewis_0_8af277396e.jpg)
Công thức Lewis là gì? Cách viết công thức Lewis và ứng dụng trong hóa học
Tìm hiểu công thức Lewis là gì và những khái niệm liên quan đến công thức này. Hướng dẫn chi tiết cách viết công thức Lewis, ví dụ minh họa cụ thể giúp bạn dễ dàng nắm chắc công thức. Thông qua việc hiểu rõ công thức Lewis để ứng dụng vào trong hóa học.
Công thức Lewis là một khái niệm cơ bản trong hóa học được sử dụng để mô tả cấu trúc phân tử thông qua cách sắp xếp các electron xung quanh nguyên tử. Công thức này giúp chúng ta hiểu rõ hơn về cách các nguyên tử liên kết với nhau trong các phân tử và ion, từ đó giải thích được tính chất và hoạt động của các chất hóa học. Bài viết dưới đây FPT Shop sẽ giúp bạn đọc cập nhật những kiến thức quan trọng về công thức Lewis, hãy theo dõi nhé!
Khái niệm công thức Lewis là gì?
Công thức Lewis còn gọi là công thức chấm electron và được nhà hóa học người Mỹ Gilbert N. Lewis phát triển vào năm 1916. Công thức này thể hiện cấu tạo phân tử qua các liên kết và các electron hóa trị riêng. Khi thay mỗi cặp electron dùng chung trong công thức electron bằng một gạch nối (-) ta được công thức Lewis.
Dưới đây là một số khái niệm liên quan đến công thức Lewis:
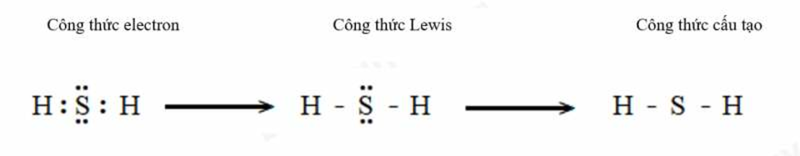
- Electron hóa trị là các electron nằm ở lớp vỏ ngoài cùng và các phân lớp gần ngoài cùng chưa bão hòa. Nó có khả năng tham gia vào quá trình hình thành liên kết hóa học.
- Electron chung là các electron hóa trị tham gia trực tiếp vào việc tạo liên kết hóa học giữa các nguyên tử.
- Electron hóa trị riêng (hay electron tự do) là các electron hóa trị không tham gia vào quá trình tạo liên kết hóa học.
- Công thức electron của một phân tử biểu diễn sự phân bố của các electron hóa trị, bao gồm cả electron hóa trị riêng của từng nguyên tử và các electron chung trong liên kết hóa học của phân tử đó.
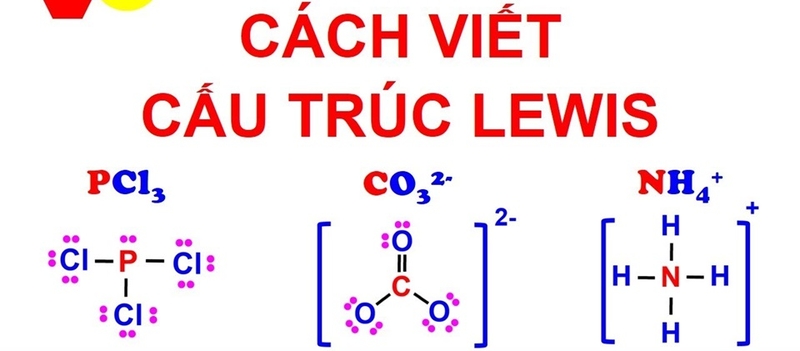
- Liên kết đơn giữa hai nguyên tử được biểu diễn bằng một cặp electron chung, ký hiệu là một dấu gạch ngang (-).
- Liên kết đôi hoặc liên kết ba tương ứng được biểu thị bằng hai hoặc ba cặp dấu gạch ngang.
- Quy tắc octet (bát tử) là khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc chia sẻ electron để đạt được cấu hình electron ổn định với 8 electron ở lớp vỏ ngoài cùng hoặc 2 electron ở lớp ngoài cùng đối với helium.
Cách viết công thức Lewis
Để vẽ chính xác công thức Lewis của một phân tử, bạn cần tuân theo trình tự các bước dưới đây.
- Bước 1: Xác định số electron hóa trị
Mỗi nguyên tử có một số electron hóa trị, tương ứng với nhóm của nó trong bảng tuần hoàn. Chẳng hạng nguyên tử Cl có 7 electron hóa trị. Tổng số electron hóa trị trong phân tử Cl2 là 7 x 2 = 14 electron.

- Bước 2: Xác định cấu trúc khung và liên kết các nguyên tử bằng cặp electron
Cấu trúc khung là cách các nguyên tử được sắp xếp trong phân tử. Nguyên tử có độ âm điện thấp hơn thường là nguyên tử trung tâm. Chúng ta cần sử dụng các cặp electron để tạo liên kết giữa nguyên tử trung tâm và các nguyên tử khác. Mỗi liên kết đơn sử dụng một cặp electron. Chẳng hạn như: khung phân tử Cl2 là Cl – Cl.
- Bước 3: Phân phối electron còn lại
Tiếp theo, hãy phân phối các electron còn lại để đảm bảo mỗi nguyên tử (trừ hidro) có đủ 8 electron (quy tắc bát tử). Nếu cần thiết, chúng ta có thể sử dụng liên kết đôi hoặc ba để đạt được cấu hình electron ổn định.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ Cl2 là 14 – 2 = 12 electron
Trong phân tử Cl2, mỗi nguyên tử Cl mới có 2 electron, cần bổ sung thêm 6 electron để đạt octet. Ta được công thức Lewis của Cl2 như sau:
Một số ví dụ minh họa cụ thể
Để giúp bạn hiểu rõ và nắm chắc hơn về cách viết công thức Lewis, dưới đây là ví dụ minh họa cụ thể của một số phân tử phổ biến.
Viết công thức Lewis của H2O
- Bước 1: Xác định số electron hóa trị
Oxygen có 6 electron hóa trị, hydrogen có 1 electron hóa trị. Trong phân tử H2O có 1 nguyên tử O và 2 nguyên tử H. Vậy tổng số electron hóa trị là 6 + 1 x 2 = 8 electron.
- Bước 2: Xác định cấu trúc khung và liên kết các nguyên tử bằng cặp electron
Trong phân tử H2O, O cần 2 electron để đạt octet, H cần 1 electron để đạt octet. Vì vậy, O là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh: H – O – H
- Bước 3: Phân phối electron còn lại
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là 8 – 2 x 2 = 4 electron. Nguyên tử H đủ octet, O cần hoàn thiện octet. Xung quanh nguyên tử O mới có 4 electron, cần bổ sung 4 electron vào nguyên tử O. Ta được công thức Lewis của H2O:
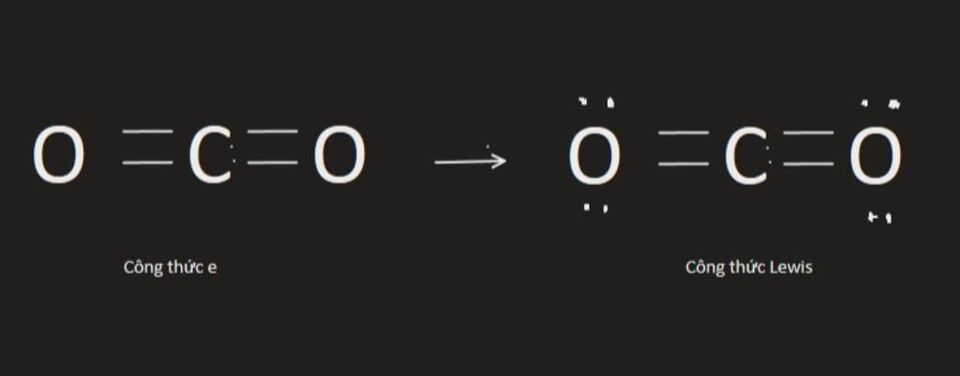
Viết công thức Lewis của CO2
- Bước 1: Xác định số electron hóa trị
Cacbon có 4 electron hóa trị, Oxygen có 6 electron hóa trị. Trong phân tử CO2 có 1 nguyên tử cacbon và 2 nguyên tử Oxygen. Vậy tổng số electron hóa trị là 4 + 6 x 2 = 16 electron.
- Bước 2: Xác định cấu trúc khung và liên kết các nguyên tử bằng cặp electron
Trong phân tử CO2, C có độ âm điện nhỏ hơn, ngoài ra nguyên tử C cần 4 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vậy C là nguyên tử trung tâm, các nguyên tử O được xếp xung quanh: O – C – O
- Bước 3: Phân phối electron còn lại
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 16 – 2 x 2 = 12. Xung quanh mỗi nguyên tử O mới có 2 electron nên cần phải bổ sung 6 electron vào mỗi nguyên tử này.
Số electron hóa trị còn lại: 12 – 6 x 2 = 0. Nguyên tử trung tâm C có 4 electron hóa trị, chưa đạt octet. Chúng ta cần chuyển một cặp electron của mỗi nguyên tử Oxygen thành cặp electron chung giữa C và O để C đạt octet. Ta được công thức Lewis của CO2:
Ứng dụng của công thức Lewis trong hóa học
Công thức Lewis có nhiều ứng dụng quan trọng trong hóa học, dưới đây là một số ứng dụng phổ biến:
- Phân tích phản ứng hóa học: Công thức Lewis hỗ trợ việc viết và cân bằng phương trình hóa học, đặc biệt trong việc xác định các cặp electron dùng chung và các ion tham gia trong phản ứng.
- Xác định tính chất hóa học: Công thức Lewis giúp hiểu rõ hơn về các tính chất vật lý và hóa học của hợp chất. Ví dụ, các phân tử có liên kết đôi hoặc ba (như O₂, N₂) thường có độ bền cao hơn so với những phân tử chỉ có liên kết đơn.
- Nghiên cứu và phát triển: Trong nghiên cứu hóa học, công thức Lewis là công cụ quan trọng để mô tả và phân tích cấu trúc phức tạp, từ đó phát triển các chất mới với những tính năng đặc biệt.
Tạm kết
Công thức Lewis là một công cụ mạnh mẽ và đơn giản để biểu diễn cách các nguyên tử liên kết với nhau trong các phân tử. Thông qua việc hiểu rõ công thức Lewis, ta có thể dự đoán được hình dạng phân tử, tính chất hóa học và độ bền của các hợp chất. Hy vọng qua bài viết bạn sẽ có thêm kiến thức cơ bản nhưng vô cùng quan trọng để ứng dụng vào nghiên cứu hoặc học tập về hóa học.
Nếu muốn mua máy tính xách tay chính hãng phục vụ nhu cầu học tập hằng ngày, hãy đến ngay FPT Shop. Tại hệ thống cửa hàng đang áp dụng hàng loạt chương trình ưu đãi khi mua laptop dành cho học sinh, sinh viên. Bạn sẽ được lựa chọn nhiều sản phẩm với mẫu mã đa dạng và giá cả phải chăng.
Mời bạn xem thêm:
:quality(75)/estore-v2/img/fptshop-logo.png)