:quality(75)/cau_tao_nguyen_tu_cover_7fa238d37e.png)
Khám phá cấu tạo nguyên tử - Tiền đề để giải mã mọi vật chất trong vũ trụ
Cấu tạo nguyên tử là chìa khóa để hiểu về vật chất và phản ứng hóa học. Từ proton, neutron đến electron, mỗi hạt đều góp phần tạo nên thế giới xung quanh. Hãy đọc để tìm hiểu cách nguyên tử hoạt động và ứng dụng trong công nghệ hiện đại.
Cấu tạo nguyên tử là kiến thức nền tảng của khoa học tự nhiên, đặc biệt trong môn Hóa học và Vật lý. Hiểu về nguyên tử giúp ta khám phá bản chất của vật chất, cách các chất hình thành và tương tác trong thế giới xung quanh. Bài viết này sẽ giúp bạn hiểu rõ cấu tạo nguyên tử, các thành phần cơ bản và ý nghĩa của chúng trong đời sống cũng như trong khoa học hiện đại.
Nguyên tử là gì?
Nguyên tử là đơn vị nhỏ nhất của vật chất có thể tham gia phản ứng hóa học mà vẫn giữ được tính chất của nguyên tố. Theo các nhà khoa học, mọi vật thể trong vũ trụ - từ hạt cát, giọt nước đến cơ thể con người - đều được cấu tạo từ hàng tỉ tỉ nguyên tử.
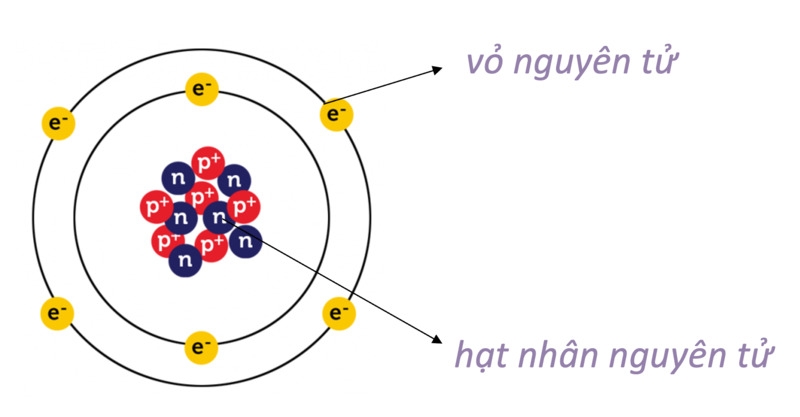
Thuật ngữ “nguyên tử” bắt nguồn từ tiếng Hy Lạp atomos, nghĩa là “không thể chia nhỏ”. Tuy nhiên, các nghiên cứu hiện đại cho thấy nguyên tử vẫn có thể chia thành những hạt nhỏ hơn: proton, neutron và electron. Đây chính là ba thành phần cơ bản trong cấu tạo nguyên tử.
Cấu tạo nguyên tử
Một nguyên tử được tạo thành từ hai phần chính: hạt nhân nguyên tử ở trung tâm và lớp vỏ electron bao quanh.
Hạt nhân nguyên tử
Hạt nhân nằm ở trung tâm, là phần mang gần như toàn bộ khối lượng của nguyên tử. Bên trong hạt nhân gồm có hai loại hạt chính:
- Proton (p): mang điện tích dương (+1).
- Neutron (n): không mang điện, trung hòa về điện tích.
Số lượng proton trong hạt nhân được gọi là số hiệu nguyên tử (Z), đồng thời xác định nguyên tố hóa học đó là gì. Ví dụ:
- Nguyên tử Hidro có 1 proton (Z = 1).
- Nguyên tử Oxi có 8 proton (Z = 8).
Tổng số proton và neutron được gọi là số khối (A) của nguyên tử.
Hạt nhân rất nhỏ nhưng cực kỳ đặc, chiếm khoảng 99,9% khối lượng của nguyên tử. Chính lực hút điện giữa proton và electron đã giữ cho toàn bộ nguyên tử ổn định.
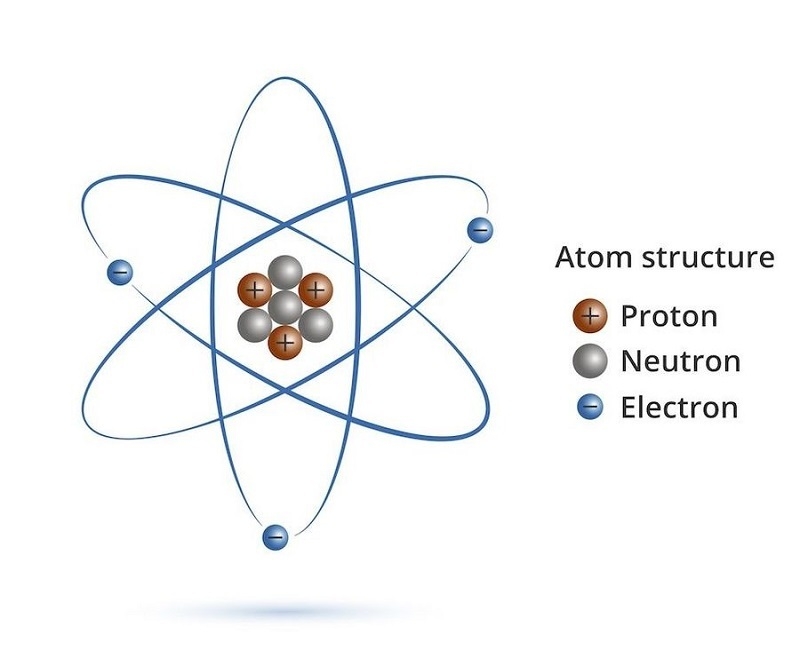
Lớp vỏ electron
Bao quanh hạt nhân là các electron (e) – những hạt mang điện âm (-1) chuyển động cực nhanh trên các quỹ đạo (hay lớp năng lượng). Mỗi electron có khối lượng nhỏ gấp 1836 lần proton, nhưng lại quyết định phần lớn tính chất hóa học của nguyên tử.
Các electron sắp xếp theo từng lớp, ký hiệu là K, L, M, N… (hoặc 1, 2, 3, 4…).
- Lớp K gần hạt nhân nhất chứa tối đa 2 electron.
- Lớp L chứa tối đa 8 electron.
- Lớp M chứa tối đa 18 electron,…
Cách sắp xếp electron theo lớp gọi là cấu hình electron, giúp xác định nguyên tử có thể liên kết với nguyên tử khác ra sao để tạo nên các phân tử, hợp chất.
Ví dụ:
- Oxi có cấu hình electron: 1s² 2s² 2p⁴ → có 6 electron lớp ngoài cùng.
- Natri có cấu hình: 1s² 2s² 2p⁶ 3s¹ → chỉ có 1 electron lớp ngoài cùng, nên dễ nhường đi để tạo liên kết ion.
Sự phát triển của mô hình cấu tạo nguyên tử
Khái niệm về nguyên tử và cấu tạo nguyên tử không dừng lại ở một hình dung cố định, mà đây là một nghiên cứu được hoàn thiện dần qua hàng trăm năm nghiên cứu.
Mô hình của Dalton (đầu thế kỷ 19)
Nhà khoa học người Anh John Dalton (1803) cho rằng nguyên tử là viên cầu đặc, nhỏ nhất, không thể chia cắt, mỗi nguyên tố được cấu tạo bởi các nguyên tử cùng loại và khác với nguyên tử của nguyên tố khác. Đây là mô hình đầu tiên đặt nền tảng cho lý thuyết nguyên tử hiện đại.
Mô hình của Thomson (1897)
Sau khi phát hiện ra electron, nhà vật lý J. J. Thomson đề xuất mô hình “bánh pudding nho”: Nguyên tử là khối cầu mang điện dương, bên trong có các electron âm phân bố đều để trung hòa điện tích. Mặc dù đơn giản, mô hình này đã chứng minh rằng nguyên tử có cấu trúc bên trong chứ không phải khối đặc như Dalton mô tả.
Mô hình của Rutherford (1911)
Thí nghiệm bắn hạt alpha của Ernest Rutherford đã phát hiện ra hạt nhân nguyên tử mang điện dương tập trung ở trung tâm, còn các electron chuyển động xung quanh trong khoảng không gian rộng lớn. Mô hình này mô tả nguyên tử giống như “hệ Mặt Trời thu nhỏ”, nhưng vẫn chưa giải thích được vì sao electron không rơi vào hạt nhân do lực hút tĩnh điện.
Mô hình Bohr và cơ học lượng tử hiện đại
Dựa trên lý thuyết lượng tử, Niels Bohr cho rằng electron chuyển động quanh hạt nhân theo các quỹ đạo có năng lượng xác định. Khi electron chuyển từ quỹ đạo này sang quỹ đạo khác, nó sẽ hấp thụ hoặc phát ra năng lượng dưới dạng photon.
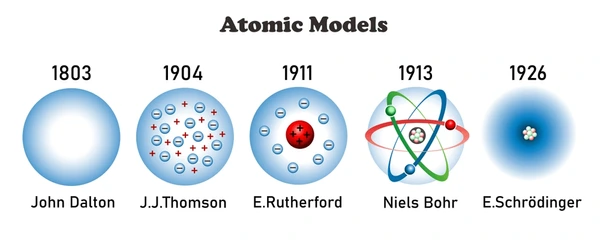
Sau này, cơ học lượng tử hiện đại (với các nhà khoa học như Schrödinger, Heisenberg, de Broglie) đã hoàn thiện mô hình này, chỉ ra rằng electron không chuyển động theo quỹ đạo cố định mà tồn tại trong vùng xác suất gọi là obitan nguyên tử.
Nhờ sự phát triển của các mô hình này, con người có thể mô tả chính xác hơn cấu tạo và hành vi của nguyên tử, từ đó giải thích được tính chất của các nguyên tố, hiện tượng quang phổ và bản chất của phản ứng hóa học.
Ý nghĩa của việc hiểu rõ cấu tạo nguyên tử
Hiểu cấu tạo nguyên tử không chỉ là kiến thức trong sách giáo khoa, mà còn là nền tảng cho hàng loạt ứng dụng khoa học – công nghệ hiện đại.
Trong hóa học
Mọi phản ứng đều bắt nguồn từ sự dịch chuyển hoặc sắp xếp lại electron giữa các nguyên tử. Khi hiểu được cách các electron phân bố, nhà khoa học có thể dự đoán tính chất của nguyên tố, biết nguyên tử nào dễ nhường hoặc nhận electron, từ đó xác định được loại liên kết hóa học mà chúng tạo ra: Liên kết ion, cộng hóa trị hay kim loại.
Trong vật lý và công nghệ
Từ những hiểu biết về cấu trúc và năng lượng bên trong nguyên tử, các nhà vật lý đã mở ra nhiều hướng phát triển công nghệ đột phá.
- Năng lượng hạt nhân: Dựa trên phản ứng phân rã hoặc tổng hợp hạt nhân, con người có thể tạo ra nguồn năng lượng khổng lồ. Nhà máy điện hạt nhân, vũ khí hạt nhân hay thậm chí năng lượng mặt trời đều liên quan đến quá trình biến đổi trong hạt nhân nguyên tử.
- Công nghệ bán dẫn: Nhờ hiểu cấu trúc electron của các nguyên tử silic, germani…, ngành điện tử đã phát triển chip vi xử lý, nền tảng cho máy tính, điện thoại và trí tuệ nhân tạo ngày nay.
- Công nghệ laser và quang phổ: Dựa vào sự chuyển mức năng lượng của electron trong nguyên tử, con người tạo ra tia laser chính xác, ứng dụng trong phẫu thuật, đo đạc và truyền dữ liệu tốc độ cao.
- Vật liệu nano: Từ việc điều khiển cấu trúc nguyên tử, khoa học vật liệu đã chế tạo ra vật liệu nhẹ hơn, bền hơn, dẫn điện tốt hơn, phục vụ hàng không, y học và năng lượng tái tạo.
Có thể nói, hiểu rõ cấu tạo nguyên tử chính là chìa khóa mở ra kỷ nguyên công nghệ hiện đại, từ cơ học lượng tử đến trí tuệ nhân tạo vật chất (AI Material Science).

Trong đời sống và giáo dục
Kiến thức về nguyên tử giúp học sinh hiểu sâu hơn về thế giới vật chất, hình thành tư duy logic, khám phá khoa học. Trong sản xuất, hiểu rõ cấu trúc nguyên tử giúp tạo ra vật liệu mới, thuốc mới, và ứng dụng năng lượng hiệu quả hơn.
Tạm kết
Cấu tạo nguyên tử tuy nhỏ bé nhưng lại là nền tảng cho mọi dạng vật chất trong vũ trụ. Việc nắm vững khái niệm này giúp con người hiểu sâu hơn về bản chất của sự vật và ứng dụng trong nhiều lĩnh vực khoa học – công nghệ.
Khám phá thế giới vi mô và những quy luật tự nhiên sẽ dễ dàng hơn khi bạn có một thiết bị mạnh mẽ đồng hành. Laptop Acer với cấu hình ổn định, màn hình sắc nét và hiệu năng cao giúp bạn học Hóa học, Vật lý, mô phỏng thí nghiệm và xử lý dữ liệu khoa học mượt mà. Hãy chọn laptop Acer để biến mỗi giờ học thành hành trình khám phá sinh động và hiệu quả hơn bao giờ hết.
Xem thêm:
Phân tử là gì? Khám phá đơn vị cơ bản tạo nên mọi chất trên Trái đất
Công thức Lewis là gì? Cách viết công thức Lewis và ứng dụng trong hóa học
:quality(75)/estore-v2/img/fptshop-logo.png)