:quality(75)/bang_tinh_tan_07_8ede8ef61b.jpg)
Bảng tính tan trong hóa học: Ý nghĩa, cách đọc, ứng dụng và các quy tắc ghi nhớ quan trọng
Bảng tính tan là một tài liệu quan trọng trong hóa học giúp xác định khả năng hòa tan của các hợp chất như axit, bazơ và muối trong nước. Bài viết này FPT Shop sẽ cung cấp thông tin chi tiết về bảng tính tan cách đọc, các quy tắc ghi nhớ quan trọng, ứng dụng của bảng tính tan.
Nếu bạn đang tìm kiếm một tài liệu đầy đủ và dễ hiểu về bảng tính tan, chia sẻ sau của FPT Shop sẽ là hướng dẫn hữu ích giúp bạn chinh phục các bài tập hóa học nhanh chóng, hiệu quả.
Tìm hiểu chất tan, chất không tan
Chất tan là chất có khả năng hòa tan hoàn toàn hoặc một phần trong dung môi (thường là nước) để tạo thành dung dịch đồng nhất. Ngược lại, chất không tan không thể hòa tan trong nước và thường tạo kết tủa hoặc tồn tại dưới dạng rắn lắng xuống đáy dung dịch.

Ví dụ:
Khi cho CaCO₃ (canxi cacbonat) và NaCl (natri clorua) vào cốc nước:
- NaCl tan hoàn toàn và tạo dung dịch trong suốt.
- CaCO₃ không tan, lắng xuống đáy cốc dưới dạng chất rắn kết tủa.
Như vậy, có những chất dễ tan, một số chất tan ít và một số chất gần như không tan trong nước. Mức độ tan của một chất phụ thuộc vào bản chất hóa học của nó.
Độ tan là gì?
Độ tan (S) của một chất là đại lượng đặc trưng cho khả năng hòa tan của chất đó trong một lượng dung môi nhất định. Trong hóa học, độ tan thường được tính bằng số gam chất tan hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.

Ví dụ: Nếu độ tan của KNO₃ (Kali nitrat) ở 20°C là 31.6 g/100g nước, điều này có nghĩa là ở nhiệt độ này, 100 gam nước chỉ có thể hòa tan tối đa 31.6 gam KNO₃. Nếu thêm nhiều hơn, phần dư sẽ không tan và lắng xuống đáy.
Phân loại chất theo độ tan
Dựa trên độ tan trong nước, các chất được phân loại thành ba nhóm chính:
- Chất tan nhiều: Nếu 100 gam nước có thể hòa tan hơn 10 gam chất tan, ta gọi đó là chất tan nhiều.
- Chất tan ít: Nếu 100 gam nước hòa tan từ 1 gam đến 10 gam chất tan, ta gọi đó là chất tan ít.
- Chất không tan (hầu như không tan): Nếu 100 gam nước hòa tan dưới 0.01 gam chất tan, ta coi chất đó là không tan trong thực tế.
Ví dụ:
- NaCl (muối ăn): Tan nhiều trong nước.
- BaSO₄ (Bari sunfat): Tan ít.
- AgCl (Bạc clorua): Hầu như không tan, tạo kết tủa trắng trong nước.
Giới thiệu về bảng tính tan
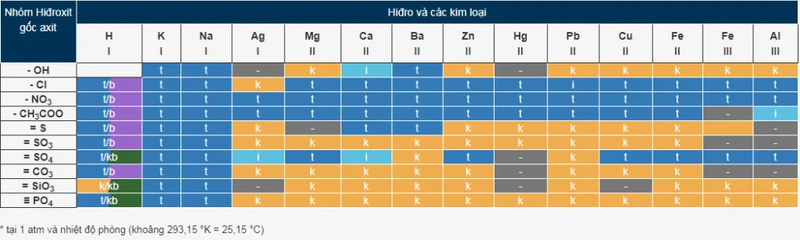
Bảng tính tan là một công cụ hữu ích trong hóa học giúp xác định khả năng hòa tan của một chất trong nước. Nó cho biết liệu một chất có tan (tan), ít tan (ít tan) hay không tan (không tan) trong nước ở điều kiện nhất định. Việc hiểu rõ bảng tính tan giúp học sinh, sinh viên và các nhà nghiên cứu dễ dàng dự đoán sản phẩm của phản ứng hóa học, đặc biệt là phản ứng trao đổi ion trong dung dịch.

Cách đọc bảng tính tan chi tiết và dễ hiểu
Để sử dụng bảng tính tan hiệu quả, bạn cần hiểu cách đọc và giải mã các thông tin trong bảng. Dưới đây là hướng dẫn chi tiết về cách đọc bảng tính tan, giúp bạn dễ dàng tra cứu và áp dụng vào thực tế.
Cấu trúc của bảng tính tan
Bảng tính tan thường được trình bày dưới dạng ma trận, trong đó:
Hàng ngang: Đại diện cho các anion (ion âm, thường là gốc axit như: Cl⁻, NO₃⁻, SO₄²⁻, CO₃²⁻, PO₄³⁻,...).
Cột dọc: Đại diện cho các cation (ion dương, thường là kim loại như: Na⁺, K⁺, Ca²⁺, Fe³⁺, Pb²⁺,...).
Tại giao điểm giữa một hàng (anion) và một cột (cation), bảng tính tan sẽ hiển thị một ký hiệu để cho biết tính tan của hợp chất tạo thành từ hai ion đó.
Các ký hiệu quan trọng trong bảng tính tan
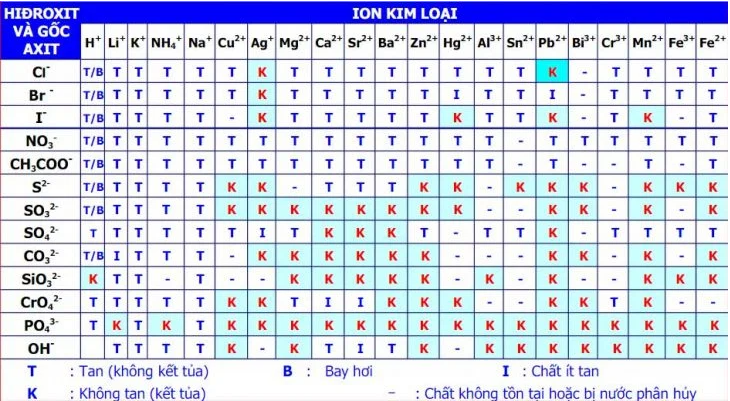
Trong bảng tính tan, mỗi hợp chất có một trạng thái hòa tan khác nhau, được biểu thị bằng các ký hiệu sau:
- T (Tan): Hợp chất này hòa tan hoàn toàn trong nước, tạo ra dung dịch trong suốt.
- I (Ít tan): Hợp chất có độ tan thấp, chỉ hòa tan một phần, có thể xuất hiện lắng cặn trong dung dịch.
- K (Không tan): Hợp chất không hòa tan trong nước và thường tạo thành kết tủa khi các ion của nó gặp nhau trong dung dịch.
- B (Bay hơi): Một số hợp chất không chỉ hòa tan mà còn có khả năng bay hơi khi phản ứng với nước, tạo ra khí.
- "-" (Không tồn tại hoặc bị phân hủy): Một số hợp chất không tồn tại hoặc bị phân hủy ngay khi tiếp xúc với nước, chẳng hạn như H₂CO₃ dễ bị phân hủy thành H₂O và CO₂.
Ví dụ minh họa cách đọc bảng tính tan
Để hiểu rõ hơn về cách đọc bảng tính tan, hãy xem xét một số ví dụ sau:

Ví dụ 1: Kiểm tra tính tan của bạc clorua (AgCl)
- Tra cứu bảng tính tan, ta thấy Ag⁺ (bạc) nằm ở cột dọc và Cl⁻ (clorua) nằm ở hàng ngang.
- Ở giao điểm của hai ion này, bảng hiển thị ký hiệu "K" (Không tan).
Điều này có nghĩa là AgCl không hòa tan trong nước, nếu trộn dung dịch chứa Ag⁺ với dung dịch chứa Cl⁻, một kết tủa trắng của AgCl sẽ xuất hiện.
Ví dụ 2: Kiểm tra tính tan của natri nitrat (NaNO₃)
- Na⁺ (natri) nằm ở cột dọc, NO₃⁻ (nitrat) nằm ở hàng ngang.
- Ở giao điểm của Na⁺ và NO₃⁻, bảng hiển thị ký hiệu "T" (Tan).
Điều này có nghĩa là NaNO₃ hoàn toàn hòa tan trong nước, không tạo kết tủa.
Ví dụ 3: Kiểm tra tính tan của bari sunfat (BaSO₄)
- Ba²⁺ (bari) nằm ở cột dọc, SO₄²⁻ (sunfat) nằm ở hàng ngang.
- Tại giao điểm của hai ion này, bảng hiển thị ký hiệu "K" (Không tan).
Như vậy, nếu trộn dung dịch chứa Ba²⁺ với dung dịch chứa SO₄²⁻, kết tủa trắng của BaSO₄ sẽ xuất hiện.
Một số quy tắc cần ghi nhớ trong bảng tính tan
Quy tắc về axit
Axit là những chất có khả năng hòa tan trong nước để tạo ra các ion H⁺ (hay còn gọi là ion hydro). Các axit có thể được chia thành axit mạnh và axit yếu, và khả năng tan của chúng trong nước cũng có sự khác biệt rõ rệt.
Axit mạnh: Hầu hết các axit mạnh như HCl (axit clohidric), H₂SO₄ (axit sunfuric), HNO₃ (axit nitric), HBr (axit bromhidric), HI (axit iotidric) và HClO₄ (axit percloric) đều tan hoàn toàn trong nước. Khi hòa tan trong nước, chúng sẽ phân ly hoàn toàn thành ion H⁺ và các ion gốc axit tương ứng.
Axit yếu: Các axit yếu như H₂CO₃ (axit cacbonic) và H₂SO₃ (axit sunfurơ) chỉ phân ly một phần trong nước và dễ bị phân hủy thành các khí như CO₂ (khí cacbonic) hoặc SO₂ (khí sunfurơ). Do đó, chúng không tan hoàn toàn trong nước.
Axit không tan: H₂SiO₃ (axit silixic) là một ví dụ về axit không tan trong nước. Khi trộn với nước, nó không phân ly và không tạo ra dung dịch axit như các axit mạnh khác.
Quy tắc về bazơ
Bazơ là những hợp chất có khả năng tạo ion OH⁻ (ion hydroxide) khi hòa tan trong nước. Các bazơ có thể được phân loại theo mức độ tan trong nước và bản chất của chúng.
Bazơ của kim loại kiềm: Các bazơ như NaOH (natri hydroxide), KOH (kalium hydroxide) hoàn toàn tan trong nước và tạo ra dung dịch kiềm mạnh. Đây là những bazơ rất dễ hòa tan và được sử dụng phổ biến trong các thí nghiệm.
Bazơ của kim loại kiềm thổ: Các bazơ như Ba(OH)₂ (bari hydroxide), Ca(OH)₂ (canxi hydroxide) chỉ tan ít trong nước, nhưng vẫn có thể tạo ra dung dịch kiềm yếu.
Bazơ không tan: Hầu hết các bazơ của kim loại chuyển tiếp như Fe(OH)₃ (sắt(III) hydroxide), Al(OH)₃ (nhôm hydroxide) không tan trong nước và tạo ra kết tủa trắng hoặc keo khi xuất hiện trong dung dịch.
Quy tắc về muối
Muối là các hợp chất được tạo thành từ phản ứng giữa axit và bazơ. Khả năng hòa tan của muối trong nước phụ thuộc vào bản chất của cation và anion.

- Muối của kim loại kiềm và amoni: Các muối của Li⁺, Na⁺, K⁺ và NH₄⁺đều tan hoàn toàn trong nước. Đây là những muối có khả năng hòa tan rất tốt, không tạo kết tủa khi trộn với nước.
- Muối nitrat và axetat: Muối nitrat (NO₃⁻) và axetat (CH₃COO⁻) luôn tan trong nước. Chúng không tạo kết tủa và dễ dàng hòa tan trong mọi điều kiện.
- Muối clorua, bromua, iotua: Các muối Cl⁻, Br⁻, I⁻ hầu hết đều tan trong nước, ngoại trừ một số muối như AgCl (bạc clorua), PbCl₂ (plumbum(II) clorua), Hg₂Cl₂ (thuỷ ngân(I) clorua) không tan, tạo kết tủa trắng.
- Muối sunfat: Các muối sunfat (SO₄²⁻) thường tan trong nước, tuy nhiên có một số muối như BaSO₄, PbSO₄ không tan, tạo kết tủa trắng. CaSO₄ chỉ tan ít trong nước.
- Muối cacbonat, sunfit và photphat: Các muối cacbonat (CO₃²⁻), sunfit (SO₃²⁻), photphat (PO₄³⁻) hầu hết không tan trong nước, trừ khi chúng phản ứng với kim loại kiềm hoặc amoni.
Ứng dụng của bảng tính tan trong hóa học
Bảng tính tan không chỉ là một công cụ để học và giảng dạy hóa học, mà còn có ứng dụng rộng rãi trong thực tiễn, đặc biệt trong các thí nghiệm và quy trình công nghiệp.
Dự đoán hiện tượng kết tủa
Khi trộn hai dung dịch muối với nhau, nếu một trong các sản phẩm phản ứng tạo thành hợp chất không tan, chúng sẽ tạo kết tủa. Sử dụng bảng tính tan, bạn có thể xác định chất nào sẽ tạo kết tủa khi các ion gặp nhau trong dung dịch.

Xác định phản ứng axit – bazơ
Bảng tính tan còn giúp bạn xác định tính tan của các bazơ trong dung dịch. Khi các bazơ không tan trong nước, chúng sẽ tạo kết tủa trong dung dịch axit, ví dụ: Khi trộn dung dịch axit với dung dịch Ba(OH)₂, ta thấy BaSO₄ không tan, tạo kết tủa trắng.
Ứng dụng trong công nghiệp
Bảng tính tan có ứng dụng quan trọng trong sản xuất hóa chất và xử lý nước thải.
Ví dụ:
- Xác định chất nào có thể hòa tan trong nước giúp sản xuất các dung dịch hóa học hiệu quả.
- Trong xử lý nước thải, bảng tính tan giúp loại bỏ các ion gây ô nhiễm thông qua quá trình tạo kết tủa.

Cách ghi nhớ bảng tính tan dễ dàng
Để học bảng tính tan hiệu quả, bạn có thể áp dụng các phương pháp sau:
- Phương pháp nhóm chất: Học bảng tính tan theo từng nhóm hợp chất như axit, bazơ, muối.
- Bài ca hóa học hoặc sơ đồ tư duy: Liên kết thông tin bằng cách tạo bài ca hóa học hoặc vẽ sơ đồ tư duy để dễ ghi nhớ.
- Luyện tập thường xuyên: Giải các bài tập hóa học liên quan đến bảng tính tan để cải thiện kỹ năng.
Một số lưu ý khi áp dụng bảng tính tan
- Áp dụng trong nước: Bảng tính tan chủ yếu áp dụng trong nước. Các chất có thể tan trong nước chưa chắc tan trong dung môi khác như rượu hoặc axeton.
- Tính tan thay đổi theo nhiệt độ: Độ tan của một số chất có thể thay đổi theo nhiệt độ, như CaSO₄ tan ít ở nhiệt độ thường nhưng tan nhiều hơn khi nhiệt độ tăng.
- Tính tan thay đổi theo áp suất: Đối với chất khí, khi tăng áp suất, độ tan của chúng trong nước sẽ tăng.
Tạm kết
Bảng tính tan và một tài liệu quan trọng giúp xác định khả năng hòa tan của các chất và dự đoán phản ứng trong dung dịch. Việc nắm vững bảng tính tan không chỉ hỗ trợ giải bài tập hóa học cách nhanh chóng mà còn giúp rất nhiều trong ứng dụng thực tế, từ xử lý nước thải, sản xuất hóa chất đến nghiên cứu khoa học. Mong rằng với những gì FPT Shop vừa chia sẻ đã giúp bạn hiểu hơn về bảng tính tan.
Hãy trang bị ngay một chiếc laptop chính hãng tại FPT Shop để hỗ trợ việc học tập, nghiên cứu hóa học và làm việc hiệu quả hơn! Sở hữu thiết kế hiện đại, hiệu năng mạnh mẽ và giá cả hợp lý, laptop ASUS là lựa chọn hoàn hảo cho học sinh, sinh viên và người đi làm. Hãy ghé ngay FPT Shop để khám phá các mẫu laptop ASUS mới nhất kèm nhiều ưu đãi hấp dẫn!
Xem thêm các mẫu laptop ASUS mới tại đây:
Xem thêm:
:quality(75)/estore-v2/img/fptshop-logo.png)